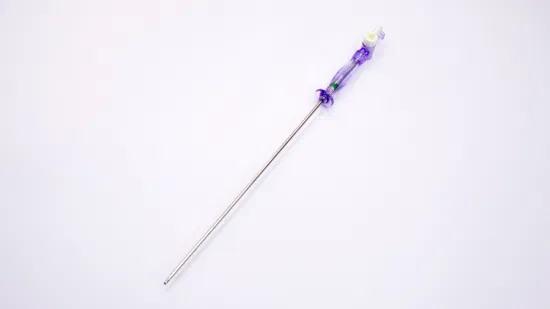
Medizinische Einweg-Verbrauchsmaterialien für Kontrastmittel-Seidenoperationen
Beschreibung
Basisinformation.
| Modell Nr. | Inno-Hydrowire |
| FDA-Zertifikatsnummer | K172187 |
| Mindestmaßeinheit | 1 Satz/Beutel |
| Garantie | 1 Jahr |
| Genehmigungsumfang | Klasse III |
| OEM | Akzeptieren Sie OEM |
| Service nach dem Verkauf | Kostenlose Ersatzteile |
| Steifheit | Standard oder Schwer |
| Zertifizierung | ISO13485;FDA;Nmpa |
| Spitzenform | Winkel oder gerade |
| Menge | 5 |
| Flex L | 3cm |
| Transportpaket | Pappkarton |
| Spezifikation | Vollständige Spezifikationen |
| Warenzeichen | Innomed |
| Herkunft | Suzhou China |
| HS-Code | 9018909919 |
| Produktionskapazität | 50000/Jahr |
Produktbeschreibung
Unternehmensprofil
Suzhou Innomed Medical Device Co., Ltd wurde im Januar 2013 gegründet und ist ein High-Tech-Unternehmen, das sich auf die Forschung, Entwicklung und Herstellung innovativer kardiovaskulärer und zerebrovaskulärer implantierbarer medizinischer Geräte sowie interventioneller High-End-Verbrauchsmaterialien spezialisiert hat.
Das Unternehmen wurde von Dr strukturelle Herzerkrankungen. Das Unternehmen verfügt über zahlreiche Produktentwicklungsprojekte, darunter Kardiologie, Herzchirurgie, Gefäßchirurgie und andere multidisziplinäre Bereiche, und hat drei große Technologieplattformen aufgebaut: Gefäßintervention, Gefäßimplantation und strukturelle Herzerkrankungen. Die in der Entwicklung befindlichen peripheren Gefäßstents und Venenstents haben den „Grünen Kanal“ für die Sonderzulassung nationaler innovativer Medizinprodukte erhalten. Derzeit verfügt das Unternehmen über 6 ausländische Ärzte, 12 Meister und fast 100 Mitarbeiter und hat ein professionelles Produktionszentrum mit 10.000 Reinstanlagen, Forschung und Entwicklung sowie Büros auf einer Fläche von über 10.000 Quadratmetern aufgebaut und das Qualitätsmanagement nach ISO13485 bestanden Systemzertifizierung. Das Unternehmen hat drei nationale NMPA-Registrierungen für Medizinprodukte der Klasse III erhalten, darunter Führungsdrähte und Kontrastführungsdrähte, sowie zwei Registrierungen für Medizinprodukte der Klasse II. Mehrere Produkte haben die 510k-Zertifizierung in den USA und die CE-Zertifizierung in der EU erhalten und sind in vielen Ländern erhältlich, darunter Polen, Athen und Lettland. Mittlerweile hat das Unternehmen eine gute langfristige Zusammenarbeit mit vielen renommierten Universitäten, Unternehmen und Krankenhäusern im In- und Ausland aufgebaut. Das Unternehmen meldet derzeit fast 100 Patente an, von denen viele in Europa und den Vereinigten Staaten angemeldet sind. Im Jahr 2017 wurde das Unternehmen als nationales High-Tech-Unternehmen ausgezeichnet, und im Jahr 2019 wurde es als eines der Top 10 der Medizinbranche ausgezeichnet Anbieter von Gerätelösungen im asiatisch-pazifischen Raum von Outlook Medtech. Mit Markt und Forschung und Entwicklung als treibende Kraft für die Weiterentwicklung hat Innomed Medical eine technologische Innovationsplattform aufgebaut und kontinuierlich innovative medizinische Geräte mit unabhängigen Rechten an geistigem Eigentum auf den Markt gebracht. Produktbeschreibung Der Inno-Hydrowire soll einen Katheter an die gewünschte anatomische Stelle führen des Gefäßsystems bei diagnostischen oder interventionellen Eingriffen. Es wird steril geliefert und ist nur für den einmaligen Gebrauch bestimmt. Es besteht aus einem Kerndraht aus einer Nickel-Titan-Legierung; eine Polymerbeschichtung (Pebax mit BaSO4 für Röntgensichtbarkeit); und eine hydrophile Beschichtung, die auf den gesamten Draht aufgetragen wird. Es gibt zwei Schaftkonfigurationen: Standard und steif. Es gibt zwei distale Spitzenformen: gerade und abgewinkelt. Der Inno-Hydrowire enthält eine 3 cm lange flexible Spitze. Der Inno-Hydrowire ist in einem Kunststoffspender verpackt, der in einer Einzelverpackung enthalten ist. Im Lieferumfang ist ein Drehmoment enthalten, das mit dem proximalen Ende des Führungsdrahts verbunden wird und zum Drehen und Steuern des Führungsdrahts dient. Die Führungsdrähte sind in einem Karton verpackt, der fünf einzelne Führungsdrähte enthält. Produktvorteil 1. Hergestellt aus Nickel-Titan-Kerndraht, mit guter Torsionskontrolle und Unterstützung. 2. Oberfläche mit hydrophiler Beschichtung beschichtet, gute Stabilität der Beschichtung, wodurch die Gleitfähigkeit des Führungsdrahts erhöht wird. 3. Guter Entwicklungseffekt und präzise Positionierung unter Röntgengeräten. 4. Ein Führungsdraht von 0,018 Zoll und weniger kann die feinen Gefäße erreichen. Produktleistung
| Durchmesser (Zoll) | Härte des Drahtkerns | Spitzenmorphologie | Länge (cm) |
| 0,014 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,018 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,022 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,025 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,032 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,035 | Standard- und Harttyp | Gerader und abgewinkelter Typ | 80/150/180/260 |
| 0,038 | Standard-Typ | Gerader und abgewinkelter Typ | 80/150/180/260 |
Lager- und Transportbedingungen: Das Produkt wird in einer Umgebung mit normaler Temperatur, sauber, guter Belüftung und ohne korrosive Gase gelagert, wobei direkte Sonneneinstrahlung und eine Lagerung in einer Umgebung mit ungewöhnlichen Temperaturen und hoher Luftfeuchtigkeit vermieden werden.
Einsatzbereich
Es wird hauptsächlich für die präoperative Kontrastdiagnose, den geführten Kontrastkatheter, die interventionelle Therapie, den geführten Ballondilatationskatheter oder den Stent verwendet.
Hinweise zur Verwendung
Der Inno-Hydrowire-Führungsdraht soll bei diagnostischen oder interventionellen Eingriffen einen Katheter an die gewünschte anatomische Stelle im Gefäßsystem führen. Dieses Gerät ist nicht für das Neuro- oder Koronargefäßsystem bestimmt.
Kontraindikationen
Der Inno-Hydrowire-Führungsdraht ist nicht für die Verwendung in folgenden Bereichen vorgesehen: • dem Neurogefäßsystem, • dem Koronargefäßsystem, • dem Patienten, der für einen perkutanen Eingriff als nicht akzeptabel erachtet wird
Warnungen
•Manipulieren oder ziehen Sie den Führungsdraht nicht durch eine Metallnadel oder einen Dilatator heraus.•Das Gerät darf nicht gegen einen Widerstand unbekannter Ursache vorgeschoben oder herausgezogen werden. Bestimmen Sie die Ursache mithilfe einer Röntgenaufnahme und ergreifen Sie die erforderlichen Maßnahmen. Eine übermäßige Krafteinwirkung gegen den Widerstand kann zur Perforation/oder Beschädigung des Gefäßes führen Gleitfähigkeit. • Formen (umformen) Sie den Führungsdraht auf keinen Fall. Das Umformen des Drahtes kann zu Schäden und Brüchen führen. • Im Lieferumfang des Führungsdrahtes ist ein Drehmomenter enthalten, der zum Drehen und Steuern des Geräts dient. Es kann zu keinem Zeitpunkt in den Patienten eingeführt werden. • Der Führungsdraht darf von einem Arzt verwendet werden, der gründlich in der Einführung, Handhabung und Beobachtung von Führungsdrähten unter Durchleuchtung geschult ist. • Das Gerät sollte sicher und ordnungsgemäß gemäß den örtlichen Vorschriften und Gesetzen entsorgt werden.
Vorsichtsmaßnahmen
•Ärzte sollten die Eignung des Geräts beurteilen oder geeignete Spezifikationen des Geräts entsprechend dem Zustand des Patienten und seinen eigenen Schulungsfähigkeiten und Erfahrungen auswählen.• Das Gerät muss vor der Entnahme aus dem Spender angefeuchtet werden, um die Gleitfähigkeit sicherzustellen. Es wird eine heparinisierte physiologische Kochsalzlösung empfohlen.• Vor dem erneuten Einführen des Geräts während des gleichen Eingriffs sollte der Draht in heparinisierter Kochsalzlösung gespült werden. Blutrückstände oder andere Fremdkörper können durch Abwischen des Geräts mit Gaze, die mit heparinisierter Kochsalzlösung befeuchtet wurde, entfernt werden. Durch die Reinigung werden Fremdstoffe nicht vollständig entfernt, daher ist das Gerät nur für den EINMALIGEN GEBRAUCH bestimmt.
Gebrauchsanweisung
1) Bereiten Sie den Führungsdraht und alle Verbindungsgeräte gemäß den Anweisungen des Herstellers vor. 2) Nehmen Sie den Führungsdraht und die Schlaufe zusammen unter Verwendung einer sterilen aseptischen Technik aus der Verpackung im sterilen Bereich. 3) Spülen Sie die Schlaufe mit einer Spritze mit heparinisierter Kochsalzlösung durch das Rohr der Schlaufe führen, um die Gleitfähigkeit der Oberfläche zu erhöhen.4) Entfernen Sie den Führungsdraht aus der Schlaufe und überprüfen Sie den Führungsdraht vor der Verwendung; Stellen Sie sicher, dass er geschmiert ist. HINWEIS: Wenn sich der Führungsdraht nicht leicht aus der Schlaufe entfernen lässt, injizieren Sie mehr heparinisierte Kochsalzlösung in die Schlaufe.5) Injizieren Sie vor der Verwendung heparinisierte physiologische Kochsalzlösung in den Katheter, um sicherzustellen, dass sich der Führungsdraht leicht darin bewegen kann des Katheters.6) Erhöhen Sie das Drehmoment am proximalen Ende des Drahtes und stellen Sie sicher, dass es keine Bewegung zwischen ihnen gibt.7) Halten Sie beim Einführen mindestens 5 cm der Spitze des Drahtes aus der Schlinge heraus. Drücken Sie den Führungsdraht vorsichtig unter Durchleuchtung und drehen Sie ihn um.8) Halten Sie den Führungsdraht in Position und schieben Sie den Katheter über den Führungsdraht und in die Zielläsion vor.9) Schließen Sie den Eingriff ab und entfernen Sie den Führungsdraht und den Katheter gemäß dem Standardverfahrensprotokoll.10) Entsorgen Entsorgen Sie den Führungsdraht gemäß den Richtlinien Ihrer Einrichtung zu gefährlichen Abfällen.
Produktlinie
Zertifikat
Hast du eine Frage? Hier finden Sie unsere FAQs.
Prev: Medizinische Verbrauchsmaterialien ohne Bindepapier-Pads, zahnmedizinische Papierlätzchen
Nächste: Medizinisches Atemtherapiegerät für den Heim- und Krankenhausgebrauch Bipap
Unser Kontakt